[Bruker]MALDI-TOF影像質譜-揭示深層分子訊息

基質輔助雷射脫附游離(也就是Matrix-assisted laser desorption/ionization, MALDI),在1987年由Hillenkamp 及Karas提出,至今已發展超過30年。從當時起,應用這一項「軟性游離」技術,與飛行時間質譜(亦即: MALDI -TOF MS)的結合,針對生物大分子的分析,便已提供快速與高度可靠的偵測結果,同時也提供了生命科學領域全新的分析角度。與其他質譜分析技術相比,MALDI-TOF操作簡便,不需要分析化學專業人員便可操作使用,因此近年來更是大量在基因體分析、生物標誌物鑑定、微生物鑑定、聚合物分析、質譜成像等應用層面有多元發展,也越來越被臨床檢測領域所青睞。
當今被廣泛採用的MALDI-TOF質譜技術,如前述是兩個主要核心技術的結合,即基質輔助雷射脫附游離與飛行時間質量分析技術。固然基質輔助雷射脫附游離可與飛行時間結合,同樣也可與其它質量分析方式,如四級柱、離子阱等相連接。然而脈衝式的雷射脫附游離與飛行時間質譜同樣採用脈衝式離子利用方式,因此在結合上有著相依性,使得MALDI-TOF這一質譜技術脫穎而出。這一類質譜儀器的進步革新,也就是MALDI這一分子游離技術與TOF質量分析技術的相互依賴、相互推進的發展歷程。
在MALDI-TOF技術出現後,美國Vanderbilt University的Richard Caprioli1應用這一分子偵測技術的掃描特性,自90年代中期,開始發展利用雷射掃描結合質譜分析的分子成像技術,開發出一種新的方法來確定生物大分子在組織切片中的分布,特別是對傳統的免疫化學無法進行分析的樣本。他們直接將基質液噴灑在冷凍組織切片上,並用MALDI-TOF儀器對組織切片樣品進行全掃描。這項分析技術的創新,不僅可以獲得樣品中特定分子的資訊,同時也可以在不使用化學標記的狀態下,獲得生物分子在複雜平面與空間的分布資訊。這一技術,相當於為生物組織學領域提供了組織表面生物分子的化學「顯微鏡」。
MALDI影像質譜是一個強大質譜分析工具,在無需標記的情況下、從代謝物小分子到蛋白質大分子,皆能透漏出這些分子在薄層樣品上的分布狀況。單次的MALDI成像就可以提供成千上萬種分子的空間分佈圖像,因此可以對分子的組成和空間異質性可得到以下的深度探究:
- 非標記定位大量待分析物、代謝物和蛋白質
- 成像成百上千化合物
- 探究分子的空間異質性
- 辨別分子階段的空間差異
- 結合形態學和組織學結果
由上述特徵,顯示MALDI成像的應用領域,也能利用在非標的物的研究中,例如: 臨床研究中尋找疾病致病因子和治療過程中的新型生物標誌物、藥物相關代謝物等。由於MALDI技術的空間定位組學發展,可透過對藥物及其代謝產物的分布進行直接偵測,成為臨床前期(pre-clinical)藥物開發流程中的新穎技術。
MALDI 影像質譜在製藥研發與癌症研究的應用
MALDI 影像質譜主要為雙向發展,一方面作為生物學家的一種病理研究工具3,例如: Doshisha University的Masaya Ikegawa教授,在該校生命科學部所帶領的實驗室,主要研究人類和生物的基因組學、蛋白組學和代謝組學,以協助了解、診斷和治療如阿茲海默氏症。如圖1,Aβ1–40/42和N3pE-Aβ40/42 (阿茲海默氏症病患的大腦中不同的沉積物),在分辨率分別為20μm在100μm的MALDI影像偵測下,顯示Aβ1–40和N3pE-Aβ40主要沉積在軟腦膜血管和小動脈中,然而Aβ1-42和N3pE-Aβ42則主要沉積在腦實質中。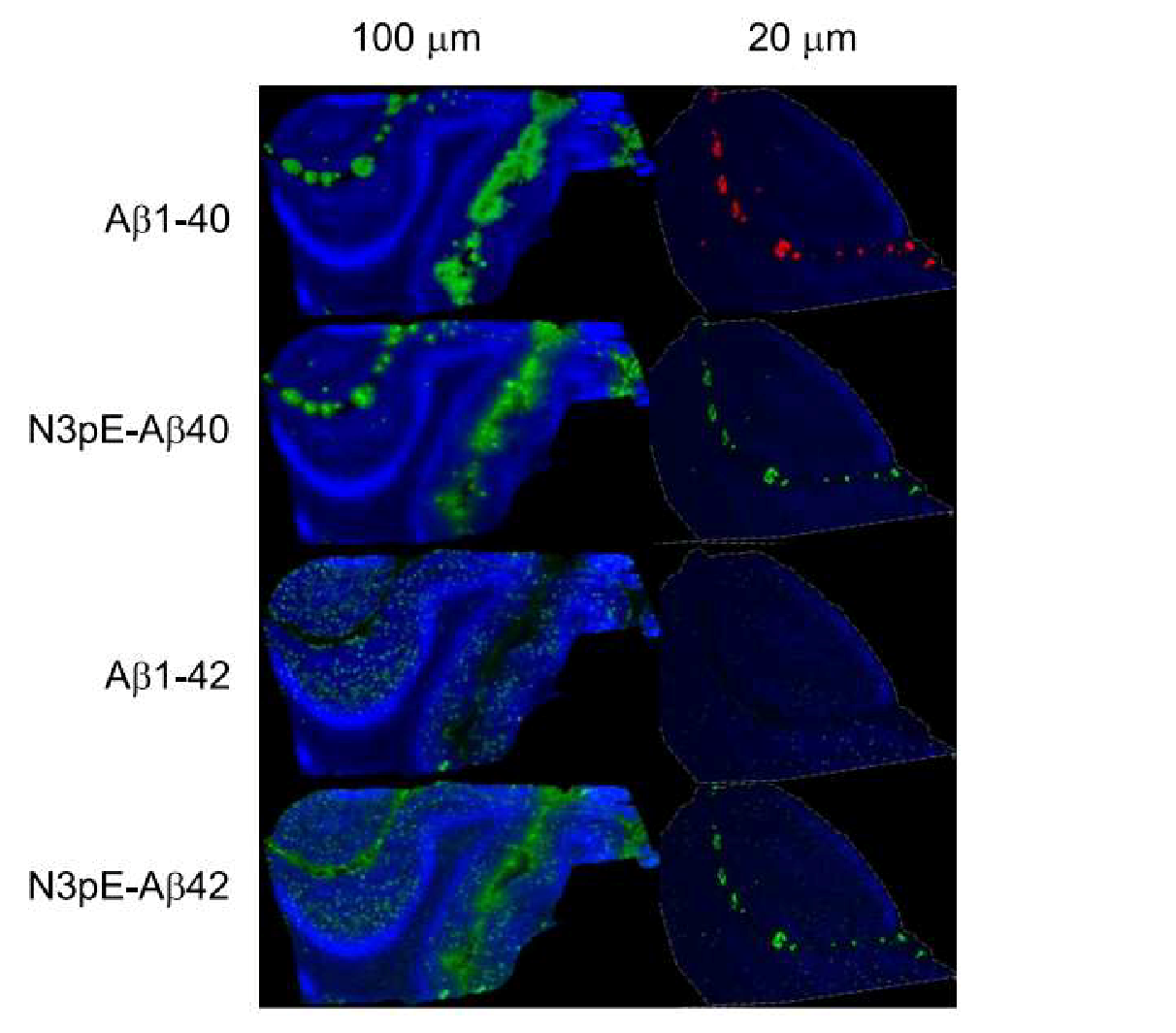
圖 1 MALDI成像提供阿茲海默氏症患者的大腦中,獨特的澱粉樣蛋白β物種沉積狀況
而MALDI影像質譜在藥物研發(Pharma R&D)中的應用也持續發展。在藥物研發過程中,需進行安全性和有效性風險評估,而多數傳統方法,僅奠基於測量動物模型和人類血漿中的原型藥物(即: parent drug)。然而,眾多研究已顯示,大多數藥物標的物在生物體內的分布並不均一,並不全然分布在血漿中,其在組織中的分布也需測定。且測定既要包括原型藥物,還應包括其一系列代謝物,才能對藥理學和毒理學有更清楚透徹的了解。
傳統分析方法,如: 定量全身放射自顯影(Quantitative whole-body autoradiography , QWBA)和液相層析質譜(LC-MS)是研究藥物在體內分布最廣用的方法,而藥物研究工作者,現在已將分析重點轉為分析組織,而不是血漿上,但這兩項方法均未能提供完整的結果,理由說明如下。
QWBA是一種通用的方法,分析流程以及所產生的數據,也被世界各地的藥物監管機構所接受(如: 美國食品藥物管理局FDA)。但是,它需要使用放射性物質作為藥物標記,而後呈現的數據也是體內總放射性物質的總和,包括原型藥物、藥物代謝物、雜質和降解產物的各種組合,因此無法分別針對代謝物與藥物的分布差異得到結果。
LC-MS的分析,是將體液、組織均質化後萃取、前處理後分析,顯然這項技術不能提供任何分子的空間資訊,更重要的是,甚至可能會產生誤導。例如,如果組織中的感興趣分析物具有高度局部化的特性,在萃取和均質的過程中已產生混合與稀釋效應,而後的上機分析便無法辨別區分局部空間分布,並使濃度相對降低,有時甚至低於偵測極限。
對比於以上兩種常用方法的劣勢,MALDI成像為藥物開發提供了潛在優勢。例如,MALDI成像能提供藥物及其重要代謝產物在組織樣品中的定位情形。圖2顯示了Steve Castelino (Director of Structural ID DMPK in GSK)於2011年發表的早期工作2。他們將H&E stain影像放大,可以找出組織切片中的發炎區域。對應於相同放大區域的MALDI成像圖(50μm空間分辨率),可見lapatinib 藥物的主要代謝物metabolite M10只出現在與發炎相關的區域,顯示發炎與此代謝物的直接關聯性,這是QWBA與LC-MS無法提供的結果。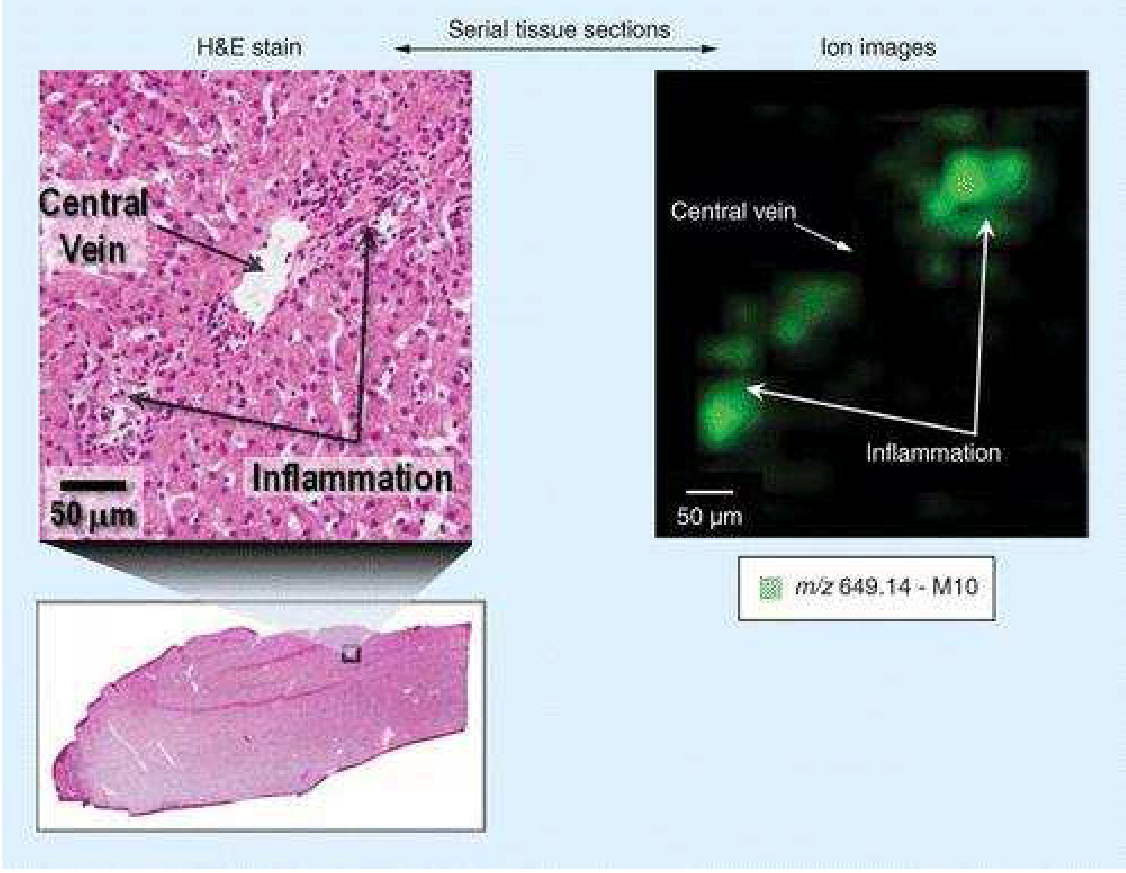
圖 2 狗肝臟切片組織學和MALDI成像的相關性
此外,MALDI成像技術也有助於尋找新的疾病生物標誌物,特別是在癌症研究領域。,由於樣本的空間分布和組織學訊息可透露出癌症樣本的異質性,MALDI成像非常適合這項工作。更重要的是,MALDI成像已經成功地應用於檢測癌症過程中,先前未知的蛋白質,以及在蛋白質N-和O-糖基化的生物標誌物上也有最新進展。MALDI成像已被用於開發腫瘤特異性聚醣生物標誌物,這些標誌物為癌症組織中特徵化的N-連接聚醣4。
質譜成像解決方案,如rapifleX MALDI-TOF質譜系統,可提供高數據收集速度(高達每秒50個真實像素);≤10 μm的像素大小,提供最高空間分辨率以獲得生物分子資訊;無重疊並且呈現準正方形的像素,在高通量和高空間分辨率的狀況下,提供穩定精準的圖像結果。Smart beam 3D的雷射提供每一個像素之間的重複性與再現性,同時rapifleX MALDI-TOF採用全新設計可自動清潔的離子源,更讓使用者長期並大量操作的壓力得以緩解。
目前先進的TOF/TOF系統已從基礎逐步發展,足以滿足對深度蛋白質分析表徵需求,並且可達成對高性能、高通量質譜成像(MSI)的要求。rapifleX MALDI-TOF新一代系統可提供更高的速度、更高的質譜解析度和精確度,也顯著提高MS/MS的質量範圍,適用於新穎的研究方向或是日常應用。此外,高通量快速分析、離子源的穩定性、更寬的動態範圍、更高的特異性等,這些生物和臨床應用中相關脂質、蛋白質的分析需求,也都能在rapifleX MALDI-TOF系統下完成。
科學家們曾期望有這樣一種系統,既能提供深度蛋白質分析表徵,也能對組織、細胞培養物或其它應用領域的成像研究。儼然MALDI成像已經做為此需求的引領者,並具有更好的廣用性、穩定性和擴增性,這對於科學研究和大規模驗證都提供充足彈性。從藥物篩選、發現過程的最初階段、高通量活性篩選(HTS),以及到藥物、代謝物成像的階段,顯見從識別潛在的候選藥物,到驗證藥物及相關產物在組織中的分布和毒性,MALDI都大有可為。
參考文獻:
- Markus Stoeckli, Pierre Chaurand, Dennis E. Hallahan & Richard M. Caprioli. Imaging mass spectrometry: A new technology for the analysis of protein expression in mammalian tissues, Nature Medicine. 7, 493 - 496, 2001.
- Castellino S, Groseclose MR, Wagner D. MALDI imaging mass spectrometry: bridging biology and chemistry in drug development, Bioanalysis. 3, 2427 - 2441, 2011.
- Kakuda N, Miyasaka T, Iwasaki N, Nirasawa T, Wada-Kakuda S, Takahashi-Fujigasaki J, Murayama S, Ihara Y, Ikegawa M. Distinct deposition of amyloid-β species in brains with Alzheimer's disease pathology visualized with MALDI imaging mass spectrometry, Acta Neuropathol Commun. 5, 73 - 80, 2017.
- Kailemia MJ, Xu G, Wong M, Li Q, Goonatilleke E, Leon F and Lebrilla CB. Recent Advances in the Mass Spectrometry Methods for Glycomicsand Cancer, Anal. Chem. 90, 208 – 224, 2018.
