首圖:

多圖: {multiple_file}
內容:
商品型號:
商品規格:
憑藉eXd 技術和TIMS的強大優勢,實現複雜結構解析和深度蛋白質變體定序。 創新融合多項技術優勢,提供無與倫比的功能多樣性。
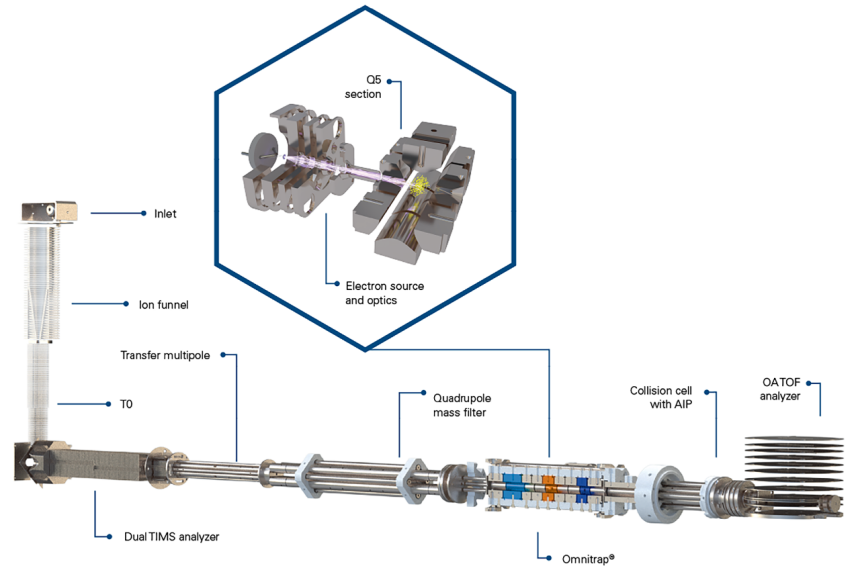
解鎖多維MS n 和eXd 捕集技術的潛力:助力MS 和MS n 靈敏度提升到新高度
獨特的Omnitrap ®平台設計,透過利用多層MS n eXd 工作流程實現離子富集和訊號放大,體驗無與倫比的全掃描MS 和MS n 靈敏度。
體驗無與倫比的MS 和MS n靈敏度
timsOmni™ 透過多維度MS n分析和離子富集,提供無與倫比的全掃描MS 和MS n靈敏度,即使對於豐度極低的離子也能顯著放大訊號。
得益於多次MS n eXd 工作流程,透過精確控制離子束,任意強度的離子均可被標靶進行電子誘導解離。
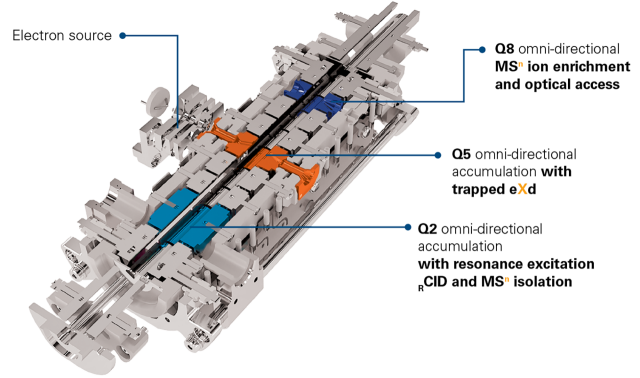
精確調節電子能量和反應時間
timsOmni™ 能夠精確調諧電子能量,從而探索多種碎裂模式,並靈活調整eXd 反應時間以獲取理想結果。憑藉所取得的完整電子碎裂圖譜,您可以設計全新的解決方案,以實現深度定序和詳細的結構解析。
捕集eXd 模式
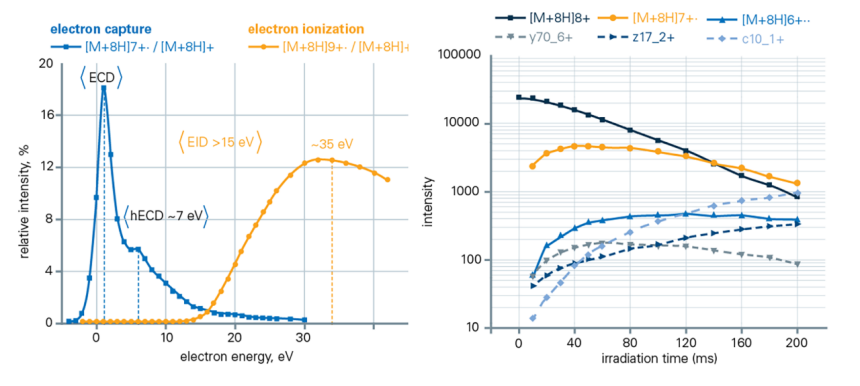
在 eXd 捕集模式下,前驅離子被捕集並在電子輻射下快速碎裂。透過調整捕集時間,可顯著提升碎片生產率,優化前驅離子消耗率(> 90%)。這種獨特的碎裂功能與傳統的單一能量和固定反應時間的碎裂技術截然不同。透過追蹤電荷減少的[M+8H]7+ • 和電荷增加的[M+8H]9+ • 產物離子的訊號隨電子能量的變化,確定了用於泛素[M+8H]8+ 離子電子捕集和電離的理想電子能量。
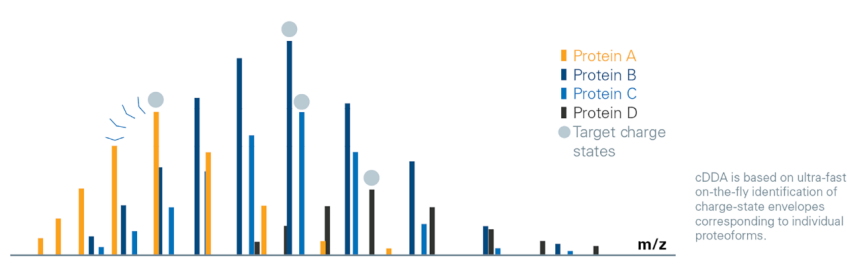
Charge DDA演算法用於由上而下蛋白質體學分析
Change DDA(cDDA)演算法在LC-MS分析過程中即時進行電荷狀態反摺積,從而實現對寬的動態範圍內共流出蛋白質變體的精確標的物分析,有效避免高豐度蛋白的冗餘碎片。透過動態地將隔離視窗切換到m/z 圖譜的非重疊區域,cDDA 顯著減少了混合圖譜的產生。cDDA 演算法是對單一蛋白質異構體的電荷態包絡進行即時快速識別。
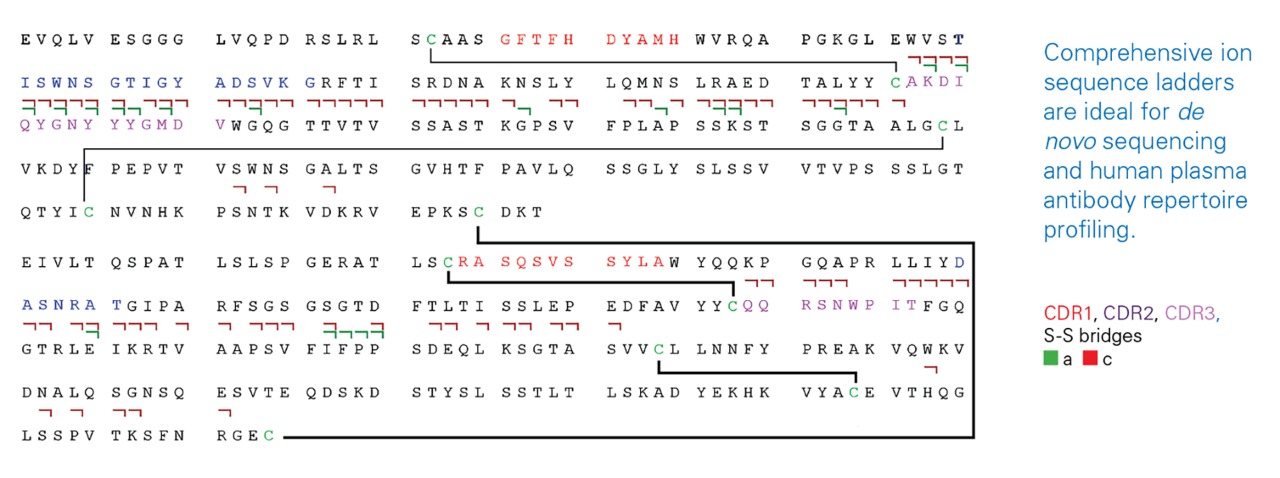
抗體互補決定區定序
全面豐富的碎片資訊是進行從頭測序和人類血漿抗體全圖譜分析的理想選擇。
分析和監測健康個體和需要治療的患者體內的抗體水平對於表徵疾病進展、識別症狀發作延遲的患者以及預測潛在的長期免疫至關重要。
- 全面豐富的碎片資訊對於表徵抗體獨特的互補決定區(CDRs)至關重要。 CDRs 是位於輕鏈和重鏈可變區內的主要高度變異,主要負責抗體對特定抗原的選擇性和親和力。
- CDR 定序是指識別這些區域確切胺基酸序列的過程,以確認抗體身份、評估潛在突變或促進抗體開發應用。
CDR 定序的卓越eXD 效率得益於以下幾點:
- 高容量eXd 區,單次掃描可儲存並處理 > 1,000 萬電荷
- 高亮度電子源,精細能量控制,加速eXd 反應
- 精確控制eXd 反應時間,確保前驅離子最大利用率
- 增強二次圖譜的訊噪比,實現最大序列覆蓋率
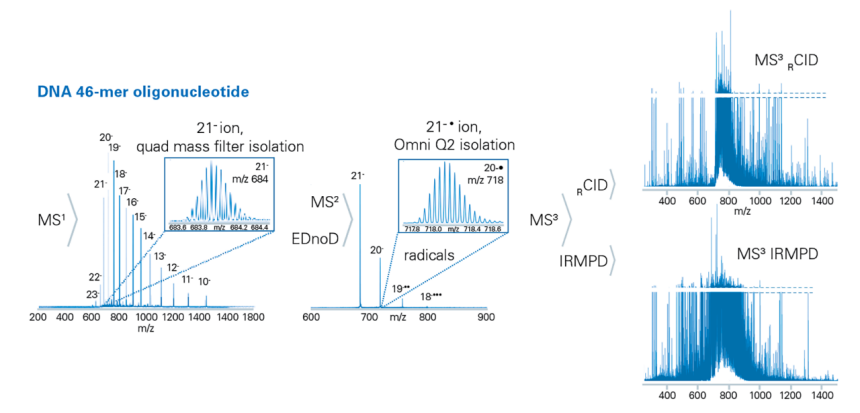
賦能深度表徵:MS n負離子模式下的寡核苷酸分析
DNA 和RNA 對於維持細胞穩定狀態至關重要,它們驅動轉譯成蛋白質並透過表觀遺傳學和RNA干擾等機制調控基因表達,現正日益廣泛地作為重要藥物形式應用於多種疾病治療領域。
表徵內源性RNA 修飾對於理解生物過程至關重要。然而,由於核苷酸種類有限以及甲基化等同位素修飾的存在,對這些分子進行精確表徵仍然具有挑戰性。寡核苷酸帶有負電荷,其表徵需要採用特殊的斷裂技術,因為儘管標準核苷酸種類有限,但可能存在多種修飾。定位內源性RNA 修飾是理解生物過程的關鍵,而結合timsOmni 技術的Top-down蛋白質體學分析則能夠達到精確定序。MS n eXd 技術可執行電子剝離解離(EDD),特別適用於寡核苷酸類治療藥物的完整蛋白質表徵。
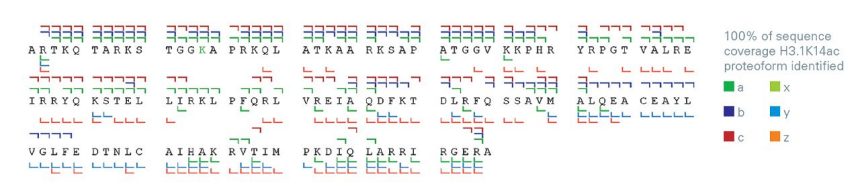
解析疾病機制的關鍵— 組織蛋白乙醯化
組織蛋白在DNA 組裝中起著關鍵作用,組織蛋白乙醯化透過改變染色質結構在基因表現調控中發揮重要作用。
理解組織蛋白乙醯化是理解癌症、神經退化性疾病、心血管疾病或代謝失調的基礎。
組織蛋白結構中修飾位點的高變異性要求資料解析工具必須能提供可靠的分析結果,timsOmni™ 最先進的碎裂能力結合OmniScape™ 軟體的智慧演算法,能夠實現高可信度的PTM 位點匹配,電荷態19+ 和20+ 的多種碎裂模式eXd (EID、ECD、CID 和ECD/CID) 碎裂結果提供完整的序列覆蓋,用於明確定位轉譯後修飾(PTM)位點。
Omnitrap 多種碎裂模式與多層次MS n技術推進應用蛋白質體學領域創新發展
細菌酵素憑藉其卓越的效率、特異性和經濟高效的生產方式,正在徹底改變工業生產流程。
在食品製造領域,這些酵素透過分解澱粉、蛋白質和果膠來促進發酵、改善質地並優化產品。
在製藥製造領域,高效能酵素可簡化藥物合成,從而提高產量並改善產品品質。
駱駝凝乳酶—— 不同碎裂模式、前驅電荷狀態和MSn 水平的結合。
透過整合工業用蛋白酶不同前驅電荷狀態下的多種碎裂模式與多次質譜分析數據,序列覆蓋率提升至92.6%。

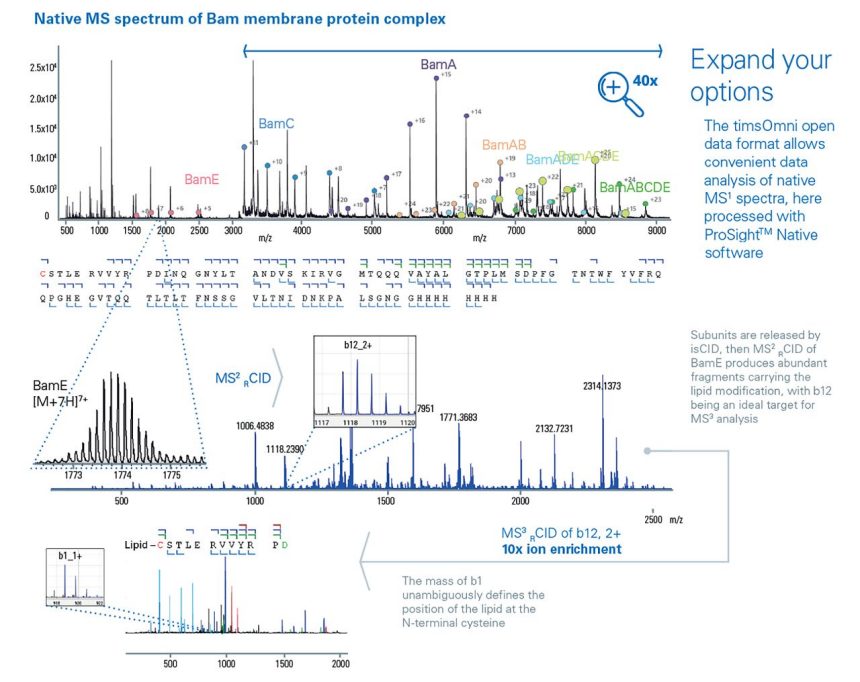
突破 native MS,實現蛋白質複合物的深度定序與轉譯後修飾(PTM)表徵
擴展分析維度:timsOmni 的開放資料格式允許方便的分析原始MS 1圖譜,這裡使用ProSight™ 軟體進行處理。
BamE 經isCID 處理所得的子離子,再經MS 2 CID 碎裂產生攜帶脂質修飾的豐富片段,其中b12 是MS 3分析的理想標靶。
理解膜蛋白如何在健康和疾病狀態下組裝以發揮功能對於藥物開發至關重要。這需要對蛋白質寡聚物、亞基相互作用、轉譯後修飾及其與配體和抑制劑的結合進行多層次分析。
新型NEOS-Source 離子源專為top-down蛋白質體學分析設計,增加噴霧穩定性和實驗再現性。
NEOS-Source: 專為top-down蛋白質體學分析打造的奈升電灑游離離子源
NEOS-Source是布魯克離子源家族中的最新成員,專為增強奈升電灑游離實驗設計,特別適用於top-down分析,提供卓越的噴霧性能和操作體驗。
核心優勢:
- 操作順暢:NEOS-Source 帶來方便且高效的電灑游離工作流程,優化整體蛋白分析實驗中大分子樣品的游離效率。
- 精準定位:內建雙攝影機系統,精準輔助霧化針定位,確保噴霧穩定性,提升資料品質與再現性。
- 全面相容:支援各種類型的霧化針,包括塗層或非塗層、開口或封閉構造,滿足不同樣品和實驗需求。
- 平台通用:NEOS-Source 專為timsOmni 平台最佳化設計,同樣適用於所有 timsTOF系列質譜儀 及MRMS 磁振造影質譜系統,可滿足於不同儀器平台下的整體蛋白分析研究需求。

MS n eXd:小分子高階結構解析利器
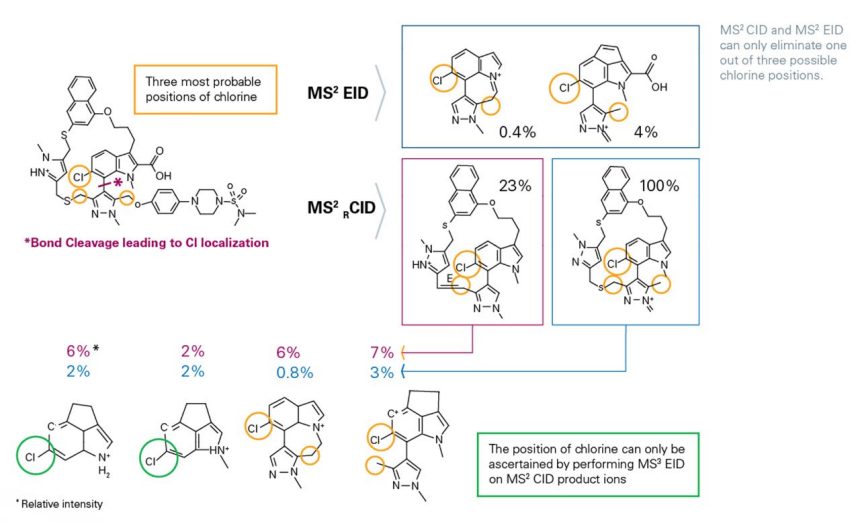
氯原子在哪裡?
芳香族氯通常不具反應性,廣泛存在於許多藥物中;而苯甲氯則是對DNA 和蛋白質具有強效烷基化作用的試劑,使其具有致癌性。因此,在微量雜質中確定氯化位置至關重要,因為苯甲氯必須受到嚴格控制,以最大限度地降低其致突變性。
timsOmni 超越了目前可用的MS n CID 和MS 2 EID 活化方法,透過MS n eXd 技術觸及先前無法到達的分子鍵,從而解決這類關鍵問題。
監測體內生物轉化產物以提高生物治療的療效
多特異性抗體作為一種領先的生物治療類別正在迅速崛起,能夠同時結合多個標靶抗原。這些創新的模式提供了新的作用機制,增強了療效,降低了抗藥性風險,並且與傳統療法相比,副作用更少。然而,與單株抗體不同,多特異性抗體在體內更容易降解,需要透過代謝物特性進行徹底分析。
整體蛋白分析和Middle-down 的質譜方法特別適合這種詳細的結構分析,因為Bottom-up 的策略往往無法獲得整體的蛋白質結構資訊。這項挑戰更加複雜的是,這些代謝物在體內樣本中的濃度極低,這使得它們的分析特別困難。引入timsOmni 標誌著一個重大進步,開啟了全面表徵多特異性抗體模式的新紀元。
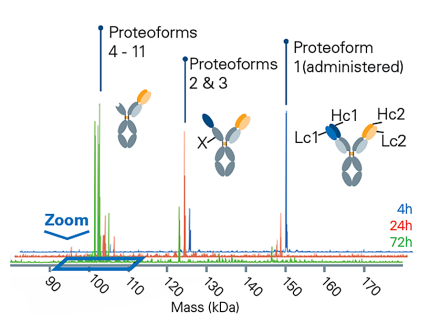
時間分辨監測體內生物轉化產物,突顯LC1 和HC1 鏈的優先剪切,這是生物治療效果下降的關鍵因素。
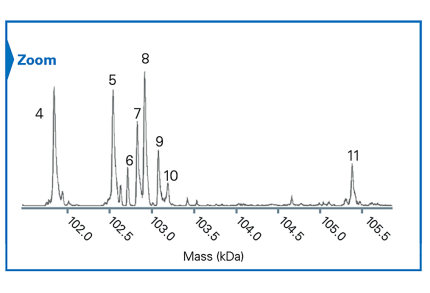
檢測極低豐度的生物轉化產物,濃度範圍從3 到30 nM,對於研究新一代生物治療藥物的體內穩定性至關重要。
商品特色:
- TIMS 提供精確CCS 值,解析構形異質性
- 碰撞誘導反折疊(CIU)以探索生物分子的構形全景
- 精確控制電子誘導碎裂(eXd),實現詳細的分子特性分析
- 多維MS n分析結合離子富集技術以實現無與倫比的靈敏度
- 捕集eXd 模式,優化前驅離子利用率,提高碎片離子產率
- 全面支援所有PASEF ®模式進行Bottom-up 蛋白質體學和多體學研究
商品說明:
加入購物車 - 購買